MV. Mg. Mercy Gisela Ramírez Velásquez
Docente asociada y responsable de la Sección de Virología del Laboratorio de Microbiología y Parasitología / Facultad de Medicina Veterinaria de la UNMSM
Introducción
El Virus de la Estomatitis Vesicular (VEV) pertenece al grupo de enfermedades vesiculares junto al virus de la fiebre aftosa (FA). Es una enfermedad viral de gran importancia en el país, no sólo por las considerables pérdidas económicas que ocasiona, sino porque dificulta las campañas de control de FA y limita las posibilidades de exportación de ganado y subproductos a otros países.
Por esta razón, es importante diferenciarlo de la FA a través de pruebas de diagnóstico rápidos y confiables, ya que el Perú tiene el reconocimiento de país libre de FA sin vacunación, desde mayo del 2018, otorgado por la Organización Mundial de Sanidad animal- (OIE).
¿Cómo se clasifica? ¿Y cuáles son sus características virales?
El VEV pertenece a la familia Rabdoviridae y género Vesiculovirus. De los agentes virales más importantes, que forman parte de esta familia viral, está el virus de la rabia que pertenece a otro género: El género Lyssavirus (ICTV, 2023).
En general, estos virus se caracterizan por ser envueltos, no segmentados, con genoma ARN de polaridad negativa y un tamaño aproximado de 11 a 15 Kb. Su genoma codifica 4 proteínas de superficie: La glicoproteína (G), la proteína de la matriz (M), la proteína de la
nucleocápside (N), la fosfoproteína (P) y la RNA polimerasa dependiente de ARN (L) (Abdelmageed y Ferran, 2020). Asimismo, codifica dos proteínas no estructurales C y C’ de función indeterminada,
codificada por un marco de lectura superpuesta en el gen P (Velazquez- Salinas et al., 2018).
La proteína G glicoproteína, es el principal componente de la membrana celular, y facilita tanto la absorción y penetración del virus como su salida de la célula infectada. Los anticuerpos neutralizantes están dirigidos contra esta proteína G y con base en ella se realiza la tipificación serológica del virus (Arboleda et al., 2005).
Existen 4 especies virales del VEV: Indiana vesiculovirus VSIV (antes Indiana -1), Cocal vesiculovirus-COCV (antes indiana -2), Alagoas vesiculovirus-VSAV (antes indiana-3) y vesiculovirus de Nueva Jersey (NJ) (OMSA: 2021). El VSIV, COCV y VSAV están estrechamente relacionados entre sí. Mientras que, VSIV y NJ son endémicos en América del Sur, siendo NJ el comúnmente reportado en casos clínicos. Con respecto al virus Alagoas, este ha sido identificado al Noreste de Brasil en bovinos, equinos y porcinos (Rocha et al., 2020).
¿A quiénes infecta y dónde se distribuye?
El VSV causa una enfermedad vesicular en équidos (caballos, mulas, asnos), bovinos, porcinos y otras especies domésticas y silvestres. El cerdo es altamente susceptible, es considerado el hospedero natural del
VEV, por esto es utilizado como modelo animal para estudios de patogénesis del VEV (Velazquez – Salinas et al., 2023).
La enfermedad natural es poco frecuente en ovejas y cabras, pero pueden infectarse experimentalmente. El hombre también es susceptible a la infección por VSV (OMSA, 2021).
La enfermedad está presente en Centro América, la parte norte de México, América del Sur, como Brasil, Argentina, Colombia (Arboleda et al., 2005) y USA con brotes epizoóticos esporádicos cada 2-10 años (Pelzel McCluskey et al., 2021). Recientemente, entre los años 2019-2020 en USA se dieron brotes del serotipo NJ e Ind del VEV, en varias especies, encontrando su relación con cepas reportadas en México (Vazquez- Salinas, 2018). Probablemente, los factores envueltos en su presentación, están determinados por condiciones climatológicas y ecológicas de los vectores (Pelzel McCluskey et al., 2021).
Signos clínicos Estudios realizados en cerdos naturalmente infectados con el vesiculovirus NJ indican que muchas de estas infecciones son subclínicas, solo el 10-15% de los animales presentan manifestaciones
clínicas (OMSA, 2021). De evidenciarse los signos clínicos, la mortalidad es cercana a cero en caballos y bovinos, pero es elevada en caso de los porcinos. La enfermedad es autolimitante, los animales enfermos se recuperan en dos semanas después de aparecer los signos clínicos y tiene un tiempo de incubación de 2-8 días dependiendo de la ruta y la cepa viral involucrada (Merck & col, 2024).
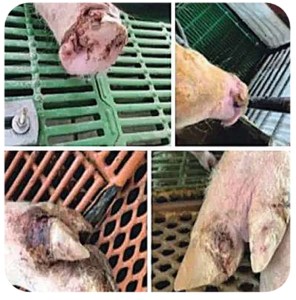
Las lesiones observadas en los animales afectados son vesículas como ampollas y erosiones que ocurren en el hocico, fosas nasales, labios, mucosa oral, pezones, ubre, abdomen ventral, orejas y bandas coronarias.
Las lesiones en la lengua y la boca causan usualmente hipersalivación y anorexia, mientras que las lesiones en bandas coronarias suelen producir cojeras (OMSA, 2021; Merck & col, 2024).
La enfermedad es zoonótica y se transmite a los humanos a través del contacto directo con las lesiones vesiculares de los animales afectados. Los signos clínicos en el hombre se parecen a una gripe leve y se caracterizan por fiebre, dolor de cabeza, fatiga, mialgia que puede durar de 3 a 5 días (Merck & col, 2024).
Las lesiones del VEV en rumiantes y en cerdos son indistinguibles clínicamente de FA, una de las enfermedades virales más económicamente devastante que afectan al ganado, por esta razón el reporte y notificación debe realizarse inmediatamente ante la autoridad sanitaria del país para que puedan realizar apropiadas pruebas de diagnóstico que confirmen o no su presencia en el país (Pelzel McCluskey et al., 2020).
Rutas de transmisión Estudios experimentales, muestran que el cerdo puede ser infectado por varias rutas con tan solo 1x 102 DICC 50 (dosis infectivas en cultivo de tejido 50) y que las manifestaciones clínicas
(desarrollo de lesiones vesiculares) es dependiente de la ruta de inoculación y dosis viral (Stallknecht et al., 2000). Un estudio realizado por Stallknecht et al., 2001, evidenció la transmisión del Vesiculovirus NJ, en cerdos experimentalmente infectados sólo cuando había evidencia de vesículas o ampollas.
El VEV es transmitido de forma directa, indirecta o a través de vectores biológicos y/o mecánicos (Stallknecht et al., 2001). La primera, se da por el contacto directo de animales susceptibles con los fluidos de las ampollas (108 /ml DICC50 para el vesiculovirus NJ), con la saliva de animales infectados y por abrasiones de la piel producto de las peleas entre los animales (Stallknecht et al., 2001). La forma indirecta, se puede dar con fómites contaminados como el alimento, el agua y los suministros veterinarios. La tercera, a través de la transmisión mecánica y biológica de vectores artrópodos, que incluyen a las moscas negras (Simulliidae), los flebótomos (Psychodidae) y mosquitos picadores Cullicoides (Ceratopogonidae); ya que se han encontrado a estos vectores, naturalmente infectados con el VEV (Mcgregor et al., 2023).
Diagnóstico del VEV El VEV no se puede diferenciar clínicamente de otras enfermedades vesiculares como FA, el exantema vesicular porcino
(EVP), la enfermedad vesicular de los cerdos (EVC) y Senecavirus. Por eso, en cualquier caso, sospechoso del VEV, es urgente un diagnóstico de laboratorio en las primeras fases de la enfermedad.
Las mejores muestras para el diagnóstico del VEV es el líquido vesicular que recubre las vesículas y el epitelio de las vesículas no reventadas. Cuando no es posible tomar muestras para la identificación del agente, porque no hay animales con evidencia clínica de la enfermedad, se pueden utilizar muestras de suero para detectar y cuantificar anticuerpos específicos.
En función de la prueba serológica que se utilice y de los antecedentes de estomatitis vesicular del país, se pueden utilizar muestras de suero pareadas del mismo animal con 7-14 días de diferencia entre una toma y
la otra (OMSA, 2021). En un estudio experimental realizado por Morozov et al., 2023, encontraron ARN viral del vesiculovirus indiana en tonsilas e hisopados nasales de cerdos experimentalmente inoculados.
Asimismo, en este estudio todos los animales fueron positivos a anticuerpos contra Indiana al día 10 post inoculación utilizando la prueba de virus neutralización.
Para el diagnóstico del VEV, se utiliza el aislamiento viral empleando usualmente dos líneas celulares: VERO (Célula epitelial de mono verde africano) y BHK-21 (célula epitelial de riñón de hámster bebe).
También, se puede utilizar para la detección de proteínas virales la prueba de ELISA indirecto de tipo sándwich, fijación de complemento y para detectar un segmento génico del VEV, el RT-PCR en tiempo real o
convencional (OMSA, 2021).
Para la detección serológica, se utiliza la prueba de virus neutralización, el ELISA de bloqueo en fase líquida o competitivo y fijación de complemento, siendo las dos primeras las más utilizadas (OMSA,
2021) En el Perú, el VEV es una enfermedad de notificación obligatoria ante el SENASA, según la “Lista de notificación obligatoria de animales terrestres en el territorio nacional” (Resolución Jefatural Nº 0029-2023-MIDAGRI- SENASA) publicada en el Diario Oficial El Peruano el 28 de febrero del 2023.
Por lo que, la Sección de Virología del Laboratorio de Microbiología y Parasitología de la Facultad de Medicina Veterinaria de la UNMSM, en apoyo al SENASA y al productor pecuario del país, brinda el servicio de diagnóstico de anticuerpos contra el VEV (vesiculovirus Indiana y el vesiculovirus New Jersey) mediante la prueba de virus neutralización
siguiendo los lineamientos establecidos en el Manual de las Pruebas de Diagnóstico y de las Vacunas para los animales terrestres de la Organización Mundial de Sanidad Animal (OMSA).
Cabe mencionar, que la Sección de Virología de la FMV UNMSM en apoyo al SENASA, viene desarrollando un proyecto de investigación que involucra la implementación de la técnica molecular de RT-PCR para la detección del VEV en muestras de cerdos con serología positiva a la prueba de virus neutralización.
Esta implementación, permitirá a la autoridad sanitaria nacional establecer medidas de control y prevención contra esta enfermedad vesicular, así como, ofrecer una herramienta para el diagnóstico diferencial contra el virus de FA.




Deja un comentario